EVEROLIMUS EG 2,5 mg, comprimé, boîte de 30
Retiré du marché le : 16/08/2019
Dernière révision : 04/12/2020
Taux de TVA : 2.1%
Prix de vente : 488,74 €
Taux remboursement SS : 100%
Base remboursement SS : 488,74 €
Laboratoire exploitant : EG LABO
Cancer du sein avancé avec récepteurs hormonaux positifs
EVEROLIMUS EG est indiqué dans le traitement du cancer du sein avancé avec récepteurs hormonaux positifs, HER2/neu négatif, en association avec l'exémestane, chez les femmes ménopausées sans atteinte viscérale symptomatique en cas de récidive ou de progression de la maladie, après un traitement par un inhibiteur non-stéroïdien de l'aromatase.
Tumeurs neuroendocrines d'origine pancréatique
EVEROLIMUS EG est indiqué dans le traitement de tumeurs neuroendocrines d'origine pancréatique non résécables ou métastatiques bien ou moyennement différenciées avec progression de la maladie chez l'adulte.
La pneumopathie non infectieuse est un effet de classe des dérivés de la rapamycine, y compris l'évérolimus. Des pneumopathies non infectieuses (y compris maladie pulmonaire interstitielle) ont été fréquemment rapportées chez des patients traités par l'évérolimus (voir rubrique Effets indésirables). Certains cas ont été sévères et, en de rares occasions, une issue fatale a été observée.
Le diagnostic de pneumopathie non infectieuse doit être envisagé chez les patients présentant des signes et symptômes respiratoires non spécifiques tels qu'hypoxie, épanchement pleural, toux ou dyspnée et lorsqu'une étiologie infectieuse, néoplasique ou toute autre cause non médicamenteuse ont été exclues par les investigations appropriées. Les infections opportunistes telles que la pneumonie à Pneumocystis jirovecii (carinii) (PPJ, PPC) devraient être exclues dans le cadre du diagnostic différentiel de pneumopathie non infectieuse (voir « Infections » ci-dessous). Il convient de recommander aux patients de signaler sans attendre tout symptôme respiratoire nouveau ou qui s'aggrave.²
Chez les patients qui développent des modifications radiologiques évoquant une pneumopathie non infectieuse sans symptôme ou accompagnées de symptômes mineurs, le traitement par EVEROLIMUS EG peut être poursuivi sans modification de la posologie. En présence d'une symptomatologie modérée (Grade 2) ou sévère (Grade 3), l'administration de corticoïdes peut être indiquée jusqu'à résolution des symptômes cliniques.
Chez les patients qui nécessitent l'utilisation de corticoïdes pour le traitement d'une pneumopathie non infectieuse, une prophylaxie de la pneumonie à Pneumocystis jirovecii (carinii) (PPJ, PPC) doit être envisagée.
Infections
L'évérolimus possède des propriétés immunosuppressives et il peut prédisposer les patients aux infections bactériennes, fongiques, virales ou aux infections à protozoaires, comprenant les infections par des agents pathogènes opportunistes (voir rubrique Effets indésirables). Des infections localisées et systémiques, incluant des pneumonies, d'autres infections bactériennes, des infections fongiques invasives telles qu'aspergillose, candidose ou pneumonie à Pneumocystis jirovecii (carinii) (PPJ, PPC) et des infections virales, notamment des cas de réactivation du virus de l'hépatite B, ont été décrites chez des patients traités par l'évérolimus. Certaines de ces infections ont été sévères (conduisant par exemple à un sepsis, une insuffisance respiratoire ou hépatique) et parfois d'issue fatale.
Les médecins et les patients doivent être conscients du risque accru d'infection associé à la prise d'EVEROLIMUS EG. Les infections préexistantes doivent être traitées de manière appropriée et la guérison complète doit être obtenue avant l'instauration d'un traitement par EVEROLIMUS EG. Au cours d'un traitement par EVEROLIMUS EG il convient d'être vigilant aux signes et symptômes d'infection : si une infection est diagnostiquée, un traitement approprié doit être instauré dans les plus brefs délais et l'arrêt temporaire ou définitif d'EVEROLIMUS EG doit être envisagé.
Si le diagnostic d'une infection fongique systémique invasive est fait, le traitement par EVEROLIMUS EG doit être arrêté immédiatement et définitivement, et le patient doit être traité par un traitement antifongique approprié.
Des cas de pneumonie à Pneumocystis jirovecii (carinii) (PPJ, PPC), dont certains avec une issue fatale, ont été rapportés chez des patients qui recevaient de l'évérolimus. La PPJ/PPC peut être associée à l'utilisation concomitante de corticostéroïdes ou d'autres agents immunosuppresseurs. Une prophylaxie des PPJ/PPC doit être envisagée lorsque l'utilisation concomitante de corticoïdes ou d'autres agents immunosuppresseurs est nécessaire.
Réactions d'hypersensibilité
Des réactions d'hypersensibilité se manifestent par des symptômes comprenant, de façon non exhaustive, anaphylaxie, dyspnée, bouffée congestive, douleur thoracique et angioedème (par exemple, gonflement des voies respiratoires et de la langue avec ou sans difficultés respiratoires) ont été observés avec l'évérolimus (voir rubrique Contre-indications).
Utilisation concomitante avec des inhibiteurs de l'enzyme de conversion de l'angiotensine (ECA)
Les patients traités de manière concomitante par des inhibiteurs de l'ECA (par exemple, ramipril) peuvent être plus à risque de développer un oedème de Quincke (par exemple, gonflement des voies respiratoires ou de la langue, avec ou sans altération de la respiration) (voir rubrique Interactions avec d'autres médicaments et autres formes d'interactions).
Stomatite
La stomatite, incluant ulcérations buccales et mucite, est l'effet indésirable le plus fréquemment rapporté chez des patients traités par évérolimus (voir rubrique Effets indésirables). La stomatite apparait le plus souvent au cours des 8 premières semaines de traitement. Une étude en simple bras chez des patientes ménopausées atteintes d'un cancer du sein traitées par évérolimus et exémestane a montré qu'une solution orale de corticoïdes sans alcool, administrée en bain de bouche pendant les 8 premières semaines de traitement, peut diminuer l'incidence et la gravité des stomatites (voir rubrique Propriétés pharmacodynamiques). La prise en charge des stomatites peut ainsi inclure l'utilisation prophylactique et/ou thérapeutique de traitements topiques, comme une solution orale de corticoïdes sans alcool utilisée en bain de bouche. Cependant, les produits à base d'alcool, d'eau oxygénée, d'iode ou de dérivés du thym doivent être évités car ils peuvent exacerber l'affection. La surveillance et le traitement des infections fongiques sont recommandés, particulièrement chez les patients ayant été traités par des médicaments à base de stéroïdes. Les agents antifongiques ne doivent pas être utilisés, sauf si une infection fongique a été diagnostiquée (voir rubrique Interactions avec d'autres médicaments et autres formes d'interactions).
Insuffisance rénale
Des cas d'insuffisance rénale (incluant des insuffisances rénales aigues) dont certains d'issue fatale, ont été observés chez des patients traités par l'évérolimus (voir rubrique Effets indésirables). La fonction rénale doit être surveillée particulièrement lorsque les patients présentent des facteurs de risques supplémentaires qui pourraient davantage altérer leur fonction rénale.
Analyses biologiques et surveillance
Fonction rénale
Des augmentations de la créatininémie, généralement légères, et de la protéinurie ont été rapportées (voir rubrique Effets indésirables). Il est recommandé de surveiller la fonction rénale, notamment l'urémie, la protéinurie ou la créatininémie, avant le début du traitement par EVEROLIMUS EG et régulièrement ensuite.
Glycémie
Des cas d'hyperglycémie ont été rapportés (voir rubrique Effets indésirables). La glycémie à jeun doit être contrôlée avant le début du traitement par EVEROLIMUS EG et régulièrement ensuite. Une surveillance plus fréquente est recommandée quand EVEROLIMUS EG est co-administré avec des médicaments pouvant induire une hyperglycémie. Dans la mesure du possible, la glycémie doit être équilibrée de façon optimale avant l'instauration du traitement par EVEROLIMUS EG.
Lipémie
Des cas de dyslipidémie (incluant des cas d'hypercholestérolémie et d'hypertriglycéridémie) ont été rapportés. Il est recommandé de surveiller la cholestérolémie et la triglycéridémie avant le début du traitement par EVEROLIMUS EG et de manière régulière par la suite, et de mettre en place un traitement approprié.
Paramètres hématologiques
Des diminutions de l'hémoglobine, des lymphocytes, des neutrophiles et des plaquettes ont été observées (voir rubrique Effets indésirables). La numération-formule sanguine doit être contrôlée avant l'instauration du traitement par EVEROLIMUS EG et régulièrement ensuite.
Tumeurs carcinoïdes fonctionnelles
Dans un essai randomisé, en double aveugle et multicentrique, réalisé chez des patients avec des tumeurs carcinoïdes fonctionnelles, l'évérolimus en association avec l'octréotide à libération prolongée a été comparé au placebo associé à l'octréotide à libération prolongée. L'étude n'a pas satisfait le critère principal d'efficacité (survie sans progression [SSP]) et l'analyse intermédiaire de la survie globale (SG) était numériquement en faveur du bras placebo associé à l'octréotide à libération prolongée. En conséquence, la sécurité et l'efficacité de l'évérolimus chez les patients atteints de tumeurs carcinoïdes fonctionnelles n'ont pas été démontrées.
Interactions
L'administration concomitante avec des inhibiteurs et des inducteurs du CYP3A4 et/ou de la glycoprotéine P (PgP), qui agit comme pompe d'efflux de nombreux médicaments, doit être évitée (voir rubrique Interactions avec d'autres médicaments et autres formes d'interactions). Si l'administration concomitante avec un inhibiteur ou un inducteur modéré du CYP3A4 et/ou de la PgP ne peut être évitée, des ajustements de dose peuvent être envisagés en fonction de l'ASC prévisible (voir rubrique Interactions avec d'autres médicaments et autres formes d'interactions).
Le traitement concomitant avec des inhibiteurs puissants du CYP3A4 entraîne une augmentation considérable de la concentration plasmatique de l'évérolimus (voir rubrique Interactions avec d'autres médicaments et autres formes d'interactions). Il n'y a pas actuellement de données suffisantes pour permettre des recommandations posologiques dans cette situation. Ainsi, le traitement concomitant par EVEROLIMUS EG avec des inhibiteurs puissants n'est pas recommandé.
La prudence est requise lorsqu'EVEROLIMUS EG est pris en association avec des substrats du CYP3A4 à marge thérapeutique étroite administrés par voie orale, en raison du risque d'interactions médicamenteuses. Si EVEROLIMUS EG est administré en association avec des substrats du CYP3A4 à marge thérapeutique étroite administrés par voie orale (par exemple : pimozide, terfénadine, astémizole, cisapride, quinidine ou dérivés de l'ergot de seigle), le patient doit être surveillé pour détecter tout effet indésirable décrit dans les mentions légales du substrat du CYP3A4 administré par voie orale (voir rubrique Interactions avec d'autres médicaments et autres formes d'interactions).
Insuffisance hépatique
L'exposition à l'évérolimus a été augmentée chez les patients présentant une insuffisance hépatique légère (classe A de Child-Pugh), modérée (classe B de Child-Pugh) et sévère (classe C de Child-Pugh) (voir rubrique Propriétés pharmacocinétiques).
L'utilisation d'EVEROLIMUS EG est uniquement recommandée chez les patients présentant une insuffisance hépatique sévère (classe C de Child-Pugh) si le bénéfice potentiel est supérieur au risque (voir rubriques Posologie et mode d'administration et Propriétés pharmacocinétiques).
Aucune donnée clinique d'efficacité ou de tolérance n'est actuellement disponible pour appuyer des recommandations d'adaptation de posologie pour la prise en charge des effets indésirables chez les patients souffrant d'une insuffisance hépatique.
Vaccinations
L'utilisation de vaccins vivants doit être évitée au cours du traitement par EVEROLIMUS EG (voir rubrique Interactions avec d'autres médicaments et autres formes d'interactions).
Lactose
Ce médicament contient du lactose. Son utilisation est déconseillée chez les patients présentant une intolérance au galactose, un déficit en lactase de Lapp ou un syndrome de malabsorption du glucose ou du galactose (maladies héréditaires rares).
Complications de la cicatrisation des plaies
Une altération de la cicatrisation des plaies est un effet de la classe des dérivés de la rapamycine, y compris l'évérolimus. La prudence est donc requise avec l'utilisation d'EVEROLIMUS EG dans la phase péri-opératoire.
Résumé du profil de tolérance
Le profil de tolérance est issu des données regroupées de 2 672 patients traités par l'évérolimus dans dix études cliniques, incluant cinq études de phase III randomisées, en double aveugle, contrôlées contre placebo et cinq études en ouvert de phase I et de phase II, liées aux indications approuvées.
Les effets indésirables les plus fréquents (fréquence ≥ 1/10) issus des données regroupées de tolérance étaient (par ordre décroissant) : stomatite, rash, fatigue, diarrhée, infection, nausée, diminution de l'appétit, anémie, dysgueusie, pneumopathie inflammatoire, oedème périphérique, hyperglycémie, asthénie, prurit, perte de poids, hypercholestérolémie, épistaxis, toux et céphalées.
Les effets indésirables de Grades 3-4 les plus fréquents (fréquence ≥ 1/100 à < 1/10) ont été : stomatite, anémie, hyperglycémie, infection, fatigue, diarrhée, pneumopathie inflammatoire, asthénie, thrombopénie, neutropénie, dyspnée, protéinurie, lymphopénie, hémorragie, hypophosphatémie, rash, hypertension, pneumonie, augmentation de l'alanine aminotransférase (ALAT), augmentation de l'aspartate aminotransférase (ASAT) et diabète. Les grades suivent la classification CTCAE version 3.0 et 4.03.
Liste des effets indésirables sous forme de tableau
Le tableau 3 montre les catégories de fréquence des effets indésirables rapportés dans les analyses des données regroupées de tolérance. Les effets indésirables sont présentés selon les classes de systèmes d'organes et les catégories de fréquence MedDRA. Les catégories de fréquence sont définies selon la convention suivante : très fréquent (≥ 1/10) ; fréquent (≥ 1/100, < 1/10) ; peu fréquent (≥ 1/1 000, < 1/100) ; rare (≥ 1/10 000, < 1/1 000) ; très rare (< 1/10 000). Au sein de chaque groupe de fréquence, les effets indésirables sont présentés suivant un ordre décroissant de gravité.
Tableau 3 Effets indésirables rapportés dans les études cliniques
| Classe de systèmes d'organes | Fréquence | Terme préférentiel |
| Infections et infestations | Très fréquent | Infectionsa,* |
| Affections hématologiques et du système lymphatique | Très fréquent | Anémie |
| Fréquent | Thrombopénie, neutropénie, leucopénie, lymphopénie | |
| Peu fréquent | Pancytopénie | |
| Rare | Érythroblastopénie | |
| Affections du système immunitaire | Peu fréquent | Hypersensibilité |
| Troubles du métabolisme et de la nutrition | Très fréquent | Diminution de l'appétit, hyperglycémie, hypercholestérolémie |
| Fréquent | Hypertriglycéridémie, hypophosphatémie, diabète, hyperlipidémie, hypokaliémie, déshydratation, hypocalcémie | |
| Affections psychiatriques | Fréquent | Insomnie |
| Affections du système nerveux | Très fréquent | Dysgueusie, céphalées |
| Peu fréquent | Agueusie | |
| Affections oculaires | Fréquent | Œdème de la paupière |
| Peu fréquent | Conjonctivite | |
| Affections cardiaques | Peu fréquent | Insuffisance cardiaque congestive |
| Affections vasculaires | Fréquent | Hémorragieb, hypertension |
| Peu fréquent | Bouffées vasomotrices, thrombose veineuse profonde | |
| Affections respiratoires, thoraciques et médiastinales | Très fréquent | Pneumopathie inflammatoirec, épistaxis, toux |
| Fréquent | Dyspnée | |
| Peu fréquent | Hémoptysie, embolie pulmonaire | |
| Rare | Syndrome de détresse respiratoire aiguë | |
| Affections gastro-intestinales | Très fréquent | Stomatited, diarrhée, nausée |
| Fréquent | Vomissements, sécheresse buccale, douleur abdominale, mucite, douleur orale, dyspepsie, dysphagie | |
| Affections hépatobiliaires | Fréquent | Augmentation de l'aspartate aminotransférase, augmentation de l'alanine aminotransférase |
| Affections de la peau et du tissu sous-cutané | Très fréquent | Rash, prurit |
| Fréquent | Sécheresse cutanée, anomalies des ongles, alopécie légère, acné, érythème, onychoclasie, syndrome mains-pieds, exfoliation cutanée, lésion cutanée | |
| Rare | Angioedème | |
| Affections musculo-squelettiques et systémiques | Fréquent | Arthralgie |
| Affections du rein et des voies urinaires | Fréquent | Protéinurie*, augmentation de la créatinémie, insuffisance rénale* |
| Peu fréquent | Augmentation des mictions diurnes, insuffisance rénale aiguë* | |
| Affections des organes de reproduction et du sein | Fréquent | Irrégularités menstruellese |
| Peu fréquent | Aménorrhéee | |
| Troubles généraux et anomalies au site d'administration | Très fréquent | Fatigue, asthénie, oedème périphérique |
| Fréquent | Pyrexie | |
| Peu fréquent | Douleur thoracique non-cardiaque, altération de la cicatrisation des plaies | |
| Investigations | Très fréquent | Perte de poids |
| * Voir également la sous-rubrique « Description de certains effets indésirables » a Inclut tous les effets de la classe d'organe « infections et infestations » y compris (fréquent) pneumonie, infection des voies urinaires ; (peu fréquent) bronchite, zona, sepsis, abcès, et cas isolés d'infections opportunistes [par exemple : aspergillose, candidose, pneumonie à Pneumocystis jirovecii (carinii) (PPJ, PPC) et hépatite B (voir aussi rubrique Mises en garde et précautions d'emploi)] et (rare) myocardite virale b Inclut différents événements hémorragiques de différents sites non cités individuellement c Inclut (fréquent) pneumopathie inflammatoire, pneumopathie interstitielle diffuse, infiltration pulmonaire et (rare) hémorragie alvéolaire pulmonaire, toxicité pulmonaire et alvéolite d Inclut (très fréquent) stomatite, (fréquent) stomatite aphteuse, ulcération buccale et de la langue et (peu fréquent) glossodynie, glossite e Fréquence fondée sur le nombre de femmes âgées de 10 à 55 ans dans les données regroupées | ||
Description de certains effets indésirables
Dans les cas rapportés au cours des études cliniques et spontanément après la commercialisation, l'évérolimus a été associé à des cas sévères de réactivation d'hépatite B, dont certains d'issue fatale. La réactivation d'infections est un effet attendu pendant les phases d'immunosuppression.
Dans les cas rapportés au cours des études cliniques et spontanément après la commercialisation, l'évérolimus a été associé à des événements d'insuffisance rénale (dont certains d'issue fatale) et de protéinurie. La surveillance de la fonction rénale est recommandée (voir rubrique Mises en garde et précautions d'emploi).
Dans les cas rapportés au cours des études cliniques et spontanément après la commercialisation, l'évérolimus a été associé à des cas d'aménorrhée (aménorrhée secondaire et autres irrégularités menstruelles).
Dans les cas rapportés au cours des études cliniques et spontanément après la commercialisation, l'évérolimus a été associé à des cas de pneumonie à Pneumocystis jirovecii (carinii) (PPJ, PPC), dont certains d'issue fatale (voir rubrique Mises en garde et précautions d'emploi).
Dans les cas rapportés au cours des études cliniques et spontanément après la commercialisation, des cas d'angioedème ont été rapportés avec et sans utilisation concomitante d'inhibiteurs de l'ECA (voir rubrique Mises en garde et précautions d'emploi).
Personnes âgées
Dans les données de tolérance regroupées, 37 % des patients traités par évérolimus avaient 65 ans ou plus. Le nombre de patients ayant présenté un effet indésirable entrainant l'arrêt du traitement était supérieur chez les patients de 65 ans et plus (20 % versus 13 %). Les effets indésirables les plus fréquents menant à l'arrêt du traitement étaient les pneumopathies inflammatoires (y compris pneumopathies interstitielles diffuses), les stomatites, la fatigue et les dyspnées.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : www.ansm.sante.fr.
SURVEILLANCE du traitement :
- symptômes respiratoires (hypoxie, épanchement pleural, toux, dyspnée),
- symptômes d'infection.
Avant le traitement et régulièrement ensuite :
- fonction rénale (urémie, protéinurie ou créatininémie),
- glycémie à jeun,
- cholestérolémie, tryglicéridémie,
- NFS.
ARRETER LE TRAITEMENT ET PREVENIR IMMEDIATEMENT LE MEDECIN en cas de :
- difficulté à respirer ou à avaler,
- gonflement du visage, des lèvres, de la langue ou de la gorge,
- démangeaisons sévères de la peau, avec une éruption rouge ou des boutons rouges.
PREVENIR LE MEDECIN en cas d’essoufflement, toux et fièvre, symptôme respiratoire nouveau ou qui s’aggrave.
EVITER la prise de millepertuis(Hypericum Perforatum), la consommation de pamplemousse et de jus de pamplemousse.
EVITER les bains de bouche à base d’alcool, d’eau oxygénée, d’iode ou de dérivés du thym en cas de stomatite, ulcération buccale et mucite buccale.
Les femmes en âge d'avoir des enfants doivent UTILISER UNE METHODE CONTRACEPTIVE HAUTEMENT EFFICACE pendant le traitement et jusqu'à 8 semaines après l'arrêt.
NE PAS ALLAITER pendant le traitement et pendant les 2 semaines qui suivent la prise de la dernière dose.
PRUDENCE en cas de conduite de véhicules ou d'utilisation de machines (fatigue).
Femmes en âge d'avoir des enfants/Contraception chez les hommes et les femmes
Les femmes en âge d'avoir des enfants doivent utiliser une méthode contraceptive hautement efficace (par exemple : méthode contraceptive hormonale ne contenant pas d'oestrogène administrée par voie orale, injectable ou implantable, contraceptifs à base de progestérone, hystérectomie, ligature des trompes, abstinence complète, méthodes barrières, dispositif intra-utérin [DIU], et/ou stérilisation de la femme/de l'homme) pendant le traitement par l'évérolimus et jusqu'à 8 semaines après l'arrêt du traitement. Il n'y a pas lieu d'interdire aux patients masculins de procréer.
Grossesse
Il n'existe pas de données suffisamment pertinentes concernant l'utilisation de l'évérolimus chez la femme enceinte. Les études effectuées chez l'animal ont mis en évidence une toxicité sur la reproduction, incluant une toxicité embryonnaire et foetale (voir rubrique Données de sécurité précliniques). Le risque potentiel en clinique n'est pas connu.
EVEROLIMUS EG n'est pas recommandé chez la femme enceinte et chez la femme en âge de procréer sans méthode contraceptive.
Allaitement
On ne sait pas si l'évérolimus est excrété dans le lait maternel humain. Cependant, les études chez le rat ont montré que l'évérolimus et/ou ses métabolites passaient facilement dans le lait (voir rubrique Données de sécurité précliniques). Par conséquent, les femmes traitées par EVEROLIMUS EG ne doivent pas allaiter pendant le traitement et pendant les 2 semaines qui suivent la prise de la dernière dose.
Fertilité
La possibilité que l'évérolimus provoque une stérilité chez les patients hommes et femmes est inconnue, néanmoins on a observé une aménorrhée (aménorrhée secondaire et autres irrégularités menstruelles) et un déséquilibre associé du rapport hormone lutéinisante (LH)/hormone folliculostimulante (FSH) chez les femmes. Les observations précliniques indiquent que le traitement par EVEROLIMUS EG peut diminuer la fertilité masculine et féminine (voir rubrique Données de sécurité précliniques).
Les interactions connues et théoriques avec des inhibiteurs et des inducteurs sélectifs du CYP3A4 et de la PgP sont décrites dans le tableau 2 ci-dessous.
Inhibiteurs du CYP3A4 et de la PgP susceptibles d'augmenter les concentrations d'évérolimus
Les inhibiteurs du CYP3A4 ou de la PgP peuvent augmenter les concentrations sanguines de l'évérolimus en diminuant le métabolisme ou l'efflux de l'évérolimus des cellules intestinales.
Inducteurs du CYP3A4 et de la PgP susceptibles de diminuer les concentrations d'évérolimus
Les substances qui sont des inducteurs du CYP3A4 et de la PgP peuvent diminuer les concentrations sanguines de l'évérolimus en augmentant le métabolisme ou l'efflux de l'évérolimus des cellules intestinales.
Tableau 2 Effets des autres substances actives sur l'évérolimus
| Substances actives par interaction | Interaction - Modifications de l'ASC et/ou de la Cmax de l'évérolimus Rapport des moyennes géométriques (intervalle des valeurs observées) | Recommandations pour l'administration concomitante |
| Inhibiteurs puissants du CYP3A4 et/ou de la PgP | ||
| Kétoconazole | ASC ↑15,3 fois (intervalle 11,2-22,5) Cmax ↑4,1 fois (intervalle 2,6-7,0) | L'administration concomitante d'évérolimus avec des inhibiteurs puissants n'est pas recommandée. |
| Itraconazole, posaconazole, voriconazole | Non étudiée, une augmentation importante des concentrations de l'évérolimus est attendue. | |
| Télithromycine, clarithromycine | ||
| Néfazodone | ||
| Ritonavir, atazanavir, saquinavir, darunavir, indinavir, nelfinavir | ||
| Inhibiteurs modérés du CYP3A4 et/ou de la PgP | ||
| Érythromycine | ASC ↑4,4 fois (intervalle 2,0-12,6) Cmax ↑2.0 fois (intervalle 0,9-3,5) | Utilisation avec précaution quand l'administration concomitante avec des inhibiteurs modérés du CYP3A4 ou de la PgP ne peut être évitée. Si l'administration concomitante avec un inhibiteur modéré du CYP3A4 ou de la PgP est requise, une réduction de dose à 5 mg par jour ou 2,5 mg par jour peut être envisagée. Toutefois, il n'y a pas de données cliniques suffisantes sur l'ajustement de dose. En raison de la variabilité entre les sujets, les ajustements de dose recommandés peuvent ne pas être optimaux pour tous les individus ; une surveillance étroite des effets indésirables est donc recommandée. Si l'inhibiteur modéré est arrêté, envisager une période d'élimination d'au moins 2 à 3 jours (temps moyen d'élimination des inhibiteurs modérés les plus utilisés) avant de reprendre la dose d'EVEROLIMUS EG utilisée avant l'instauration du traitement concomitant. |
| Imatinib | ASC ↑ 3,7 fois Cmax ↑ 2,2 fois | |
| Vérapamil | ASC ↑3,5 fois (intervalle 2,2-6,3) Cmax ↑2,3 fois (intervalle 1,3-3,8) | |
| Ciclosporine orale | ASC ↑2,7 fois (intervalle 1,5-4,7) Cmax ↑1,8 fois (intervalle 1,3-2,6) | |
| Fluconazole | Non étudiée. Exposition accrue attendue. | |
| Diltiazem | ||
| Dronédarone | Non étudiée. Exposition accrue attendue | |
| Amprénavir, fosamprénavir | Non étudiée. Exposition accrue attendue. | |
| Jus de pamplemousse ou autres aliments ayant un effet sur le CYP3A4 et/ou la PgP | Non étudiée. Exposition accrue attendue (variation élevée des effets). | L'association doit être évitée. |
| Inducteurs puissants et modérés du CYP3A4 et/ou de la PgP | ||
| Rifampicine | ASC ↓63 % (intervalle 0-80 %) Cmax ↓58 % (intervalle 10-70 %) | Éviter l'utilisation concomitante avec les inducteurs puissants du CYP3A4. Si une administration concomitante avec un inducteur puissant du CYP3A4 est requise, une augmentation de la dose d'EVEROLIMUS EG de 10 mg à 20 mg par jour doit être envisagée en utilisant une augmentation par paliers de 5 mg ou moins le 4e jour et le 8e jour suivant l'instauration du traitement par l'inducteur. Il est prévu que cette dose d'EVEROLIMUS EG permette d'ajuster l'ASC à l'intervalle de valeurs observées sans inducteur. Toutefois il n'existe aucune donnée clinique disponible avec cet ajustement de dose. Lorsque le traitement par l'inducteur est arrêté, envisager une période d'élimination d'au moins 3 à 5 jours (temps raisonnable pour une levée significative de l'induction enzymatique), avant de reprendre la dose d'EVEROLIMUS EG utilisée avant l'instauration du traitement concomitant. |
| Dexaméthasone | Non étudiée. Diminution de l'exposition attendue. | |
| Carbamazépine, phénobarbital, phénytoïne | Non étudiée. Diminution de l'exposition attendue. | |
| Efavirenz, névirapine | Non étudiée. Diminution de l'exposition attendue. | |
| Millepertuis (Hypericum Perforatum) | Non étudiée. Diminution importante de l'exposition attendue. | Les préparations contenant du millepertuis ne doivent pas être utilisées pendant un traitement par l'évérolimus. |
Produits dont la concentration plasmatique peut être altérée par l'évérolimus
En fonction des résultats des études in vitro, au vu des concentrations systémiques obtenues avec des doses de 10 mg par jour par voie orale, l'inhibition de la PgP, du CYP3A4 et du CYP2D6 est peu vraisemblable. Toutefois, l'inhibition du CYP3A4 et de la PgP dans l'intestin ne peut être exclue. Une étude d'interaction chez des sujets sains a montré que l'administration concomitante d'une dose orale de midazolam, un substrat sensible du CYP3A, avec l'évérolimus entraînait une augmentation de 25 % de la Cmax du midazolam et une augmentation de 30 % de l'ASC(0-inf) du midazolam. Cet effet est susceptible d'être dû à l'inhibition du CYP3A4 intestinal par l'évérolimus. L'évérolimus peut donc modifier la biodisponibilité des substrats du CYP3A4 administrés en association par voie orale. Toutefois, un effet cliniquement pertinent sur l'exposition aux substrats du CYP3A4 administrés par voie systémique n'est pas attendu (voir rubrique Mises en garde et précautions d'emploi).
L'administration concomitante d'évérolimus et d'octréotide à libération prolongée a augmenté la Cmin de l'octréotide avec un rapport des moyennes géométriques (évérolimus/placebo) de 1,47. Un effet cliniquement significatif sur l'efficacité de l'évérolimus chez les patients atteints de tumeurs neuroendocrines avancées n'a pas pu être établi.
L'administration concomitante d'évérolimus et d'exémestane a augmenté la Cmin et la C2h de l'exémestane de 45 % et 64 % respectivement. En revanche, les taux correspondants d'oestradiol à l'état d'équilibre (4 semaines) n'ont pas été différents entre les deux groupes de traitement. Aucune augmentation des événements indésirables liés à l'exémestane n'a été observée chez les patientes atteintes d'un cancer du sein avancé avec récepteurs hormonaux positifs recevant l'association. L'augmentation des taux d'exémestane ne devrait pas avoir d'impact sur l'efficacité ou la tolérance.
Utilisation concomitante avec des inhibiteurs de l'enzyme de conversion de l'angiotensine (ECA)
Les patients traités de manière concomitante par des inhibiteurs de l'ECA (par exemple, ramipril) peuvent être plus à risque de développer un angioedème (voir rubrique Mises en garde et précautions d'emploi).
Vaccinations
La réponse immunitaire à la vaccination peut être affectée. Ainsi, la vaccination au cours d'un traitement par EVEROLIMUS EG peut être moins efficace. L'utilisation de vaccins vivants doit être évitée pendant le traitement par EVEROLIMUS EG (voir rubrique Mises en garde et précautions d'emploi). Exemples de vaccins vivants : vaccin antigrippal intranasal, vaccins anti-rougeoleux, vaccin contre les oreillons, vaccin anti-rubéolique, vaccin antipoliomyélitique oral, vaccin BCG (bacille de Calmette et Guérin), vaccin antiamarile, vaccin contre la varicelle et vaccin antityphoïdique TY21a.
Le traitement par EVEROLIMUS EG doit être instauré et suivi par un médecin ayant l'expérience des traitements anticancéreux.
Pour les différents schémas posologiques, EVEROLIMUS EG est disponible en comprimés de 2,5 mg, 5 mg et 10 mg.
La dose recommandée d'évérolimus est de 10 mg une fois par jour. Le traitement doit être poursuivi aussi longtemps qu'un bénéfice clinique est observé ou jusqu'à la survenue d'une toxicité inacceptable.
Si une dose est oubliée, le patient ne doit pas prendre une dose supplémentaire, mais prendre la prochaine dose prescrite comme d'habitude.
Ajustement de la posologie en cas d'effets indésirables
La prise en charge d'effets indésirables sévères et/ou intolérables suspectés d'être liés au traitement peut nécessiter une réduction de dose et/ou une interruption temporaire du traitement par EVEROLIMUS EG. Pour les effets indésirables de Grade 1, une adaptation de la dose n'est généralement pas nécessaire. S'il est nécessaire de diminuer la posologie, la dose recommandée est de 5 mg par jour et elle ne doit pas être inférieure à 5 mg par jour.
Le tableau 1 résume les recommandations pour l'adaptation de la posologie en cas d'effets indésirables spécifiques (voir également rubrique Mises en garde et précautions d'emploi).
Tableau 1 Recommandations pour l'adaptation de la posologie d'EVEROLIMUS EG
| Effet indésirable | Sévérité1 | Adaptation de la posologie d'EVEROLIMUS EG |
| Pneumopathie non infectieuse | Grade 2 | Envisager l'interruption du traitement jusqu'à l'amélioration des symptômes à un Grade ≤ 1. Réintroduire le traitement à 5 mg par jour. Arrêter le traitement en l'absence de récupération dans un délai de 4 semaines. |
| Grade 3 | Interrompre le traitement jusqu'à la résolution des symptômes à un Grade ≤ 1. Envisager la reprise du traitement à 5 mg par jour. Si une toxicité de Grade 3 réapparait, envisager l'arrêt du traitement. | |
| Grade 4 | Arrêter le traitement. | |
| Stomatite | Grade 2 | Interrompre temporairement le traitement jusqu'à rétablissement à un Grade ≤ 1. Réintroduire le traitement à la même dose. En cas de récidive de la stomatite à un Grade 2, interrompre le traitement jusqu'à rétablissement à un Grade ≤ 1. Réintroduire le traitement à 5 mg par jour. |
| Grade 3 | Interrompre temporairement le traitement jusqu'à rétablissement à un Grade ≤ 1. Réintroduire le traitement à 5 mg par jour. | |
| Grade 4 | Arrêter le traitement. | |
| Autres toxicités non hématologiques (sauf événements métaboliques) | Grade 2 | Si la toxicité est tolérable, aucune adaptation de la posologie n'est nécessaire. Si la toxicité devient intolérable, interrompre temporairement le traitement jusqu'à rétablissement à un Grade ≤ 1. Réintroduire le traitement à la même dose. En cas de récidive de la toxicité à un Grade 2, interrompre le traitement jusqu'à rétablissement à un Grade ≤ 1. Réintroduire le traitement à 5 mg par jour. |
| Grade 3 | Interrompre temporairement le traitement jusqu'à rétablissement à un Grade ≤ 1. Envisager de réintroduire le traitement à 5 mg par jour. Si une toxicité de Grade 3 réapparait, envisager l'arrêt du traitement. | |
| Grade 4 | Arrêter le traitement. | |
| Événements métaboliques (par exemple, hyperglycémie, dyslipidémie) | Grade 2 | Aucune adaptation de la posologie n'est nécessaire. |
| Grade 3 | Interrompre temporairement le traitement. Réintroduire le traitement à 5 mg par jour. | |
| Grade 4 | Arrêter le traitement. | |
| Thrombopénie | Grade 2 (< 75, ≥ 50 x 109/l) | Interrompre temporairement le traitement jusqu'à rétablissement à un Grade ≤ 1 (≥ 75 x 109/l). Réintroduire le traitement à la même dose. |
| Grade 3 & 4 (< 50 x 109/l) | Interrompre temporairement le traitement jusqu'à rétablissement à un Grade ≤ 1 (≥ 75 x 109/l). Réintroduire le traitement à 5 mg par jour. | |
| Neutropénie | Grade 2 (≥ 1x109/l) | Aucune adaptation de la posologie n'est nécessaire. |
| Grade 3 (< 1, ≥ 0,5 x 109/l) | Interrompre temporairement le traitement jusqu'à rétablissement à un Grade ≤ 2 (≥ 1 x 109/l). Réintroduire le traitement à la même dose. | |
| Grade 4 (< 0,5 x 109/l) | Interrompre temporairement le traitement jusqu'à rétablissement à un Grade ≤ 2 (≥ 1 x 109/l). Réintroduire le traitement à 5 mg par jour. | |
| Neutropénie fébrile | Grade 3 | Interrompre temporairement le traitement jusqu'à rétablissement à un Grade ≤ 2 (≥ 1,25 x 109/l) et absence de fièvre. Réintroduire le traitement à 5 mg par jour. |
| Grade 4 | Arrêter le traitement. | |
| 1 Grades évalués selon les critères communs de terminologie des événements indésirables (CTCAE, Common Terminology Criteria for Adverse Events), version 3.0, de l'Institut national américain du cancer (NCI, National Cancer Institute) | ||
Populations particulières
Patients âgés (≥ 65 ans)
Aucune adaptation de la posologie n'est nécessaire (voir rubrique Propriétés pharmacocinétiques).
Insuffisance rénale
Aucune adaptation de la posologie n'est nécessaire (voir rubrique Propriétés pharmacocinétiques).
Insuffisance hépatique
· Insuffisance hépatique légère (classe A de Child-Pugh) - la dose quotidienne recommandée est de 7,5 mg.
· Insuffisance hépatique modérée (classe B de Child-Pugh) - la dose quotidienne recommandée est de 5 mg.
· Insuffisance hépatique sévère (classe C de Child-Pugh) - EVEROLIMUS EG n'est recommandé que si le bénéfice attendu est supérieur au risque. Dans ce cas, la dose quotidienne ne devra pas dépasser 2,5 mg.
Une adaptation posologique devra être effectuée si la fonction hépatique du patient (classe de Child-Pugh) change au cours du traitement (voir également rubriques Mises en garde et précautions d'emploi et Propriétés pharmacocinétiques).
Population pédiatrique
La sécurité et l'efficacité de l'évérolimus chez les enfants âgés de 0 à 18 ans n'ont pas été établies. Aucune donnée n'est disponible.
Mode d'administration
EVEROLIMUS EG doit être pris par voie orale une fois par jour à la même heure chaque jour, avec ou sans aliments de façon constante (voir rubrique Propriétés pharmacocinétiques). Les comprimés d'EVEROLIMUS EG doivent être avalés entiers avec un verre d'eau. Les comprimés ne doivent pas être mâchés ou écrasés.
Durée de conservation :
2 ans
Précautions particulières de conservation :Les cas rapportés de surdosage chez l'Homme sont très limités. Des doses uniques allant jusqu'à 70 mg ont été administrées avec une tolérance aiguë acceptable. Un traitement symptomatique approprié doit être instauré dans tous les cas de surdosage.
Mécanisme d'action
L'évérolimus est un inhibiteur sélectif de la cible de la rapamycine chez les mammifères (mTOR, mammalian target of rapamycin). mTOR est une sérine-thréonine kinase importante dont l'activité est connue comme étant régulée à la hausse dans un certain nombre de cancers humains. L'évérolimus se lie à la protéine intracellulaire FKBP-12, formant un complexe qui inhibe l'activité du complexe mTOR 1 (mTORC1). L'inhibition de la voie de signalisation du mTORC1 interfère avec la traduction et la synthèse de protéines en réduisant l'activité de la protéine S6 kinase 1 ribosomale (S6K1, S6 ribosomal protein kinase1) et de la protéine 1 se liant au facteur d'élongation 4E chez les eucaryotes (4EBP-1, eukaryotic elongation factor 4E-binding protein) qui régulent les protéines impliquées dans le cycle cellulaire, l'angiogenèse et la glycolyse. On pense que la protéine S6K1 phosphoryle le domaine contenant la fonction d'activation de la transcription 1 (AF-1, activation function 1) du récepteur aux oestrogènes, qui est responsable de l'activation du récepteur indépendamment du ligand. L'évérolimus réduit les taux de facteur de croissance de l'endothélium vasculaire (VEGF), qui potentialise les processus d'angiogenèse tumorale. L'évérolimus est un inhibiteur puissant de la croissance et de la prolifération des cellules tumorales, des cellules endothéliales, des fibroblastes et des cellules musculaires lisses vasculaires et il a été montré qu'il réduit la glycolyse au sein des tumeurs solides in vitro et in vivo.
Efficacité et sécurité clinique
Cancer du sein avancé avec récepteurs hormonaux positifs
BOLERO-2 (étude CRAD001Y2301) est une étude de phase III, multicentrique, randomisée, en double aveugle de l'évérolimus + exémestane versus placebo + exémestane conduite chez des femmes ménopausées atteintes d'un cancer du sein avancé avec récepteurs aux oestrogènes positifs, HER2/neu négatif, présentant une récidive ou une progression de la maladie après un traitement antérieur par létrozole ou anastrozole. La randomisation a été stratifiée en fonction de la sensibilité documentée à l'hormonothérapie antérieure et en fonction de la présence de métastases viscérales. La sensibilité à l'hormonothérapie antérieure a été définie comme (1) un bénéfice clinique documenté (réponse complète [RC], réponse partielle [RP], stabilisation de la maladie ≥ 24 semaines) après au moins une hormonothérapie antérieure au stade avancé ou (2) au moins 24 mois d'hormonothérapie adjuvante avant la récidive.
Le critère principal d'évaluation de l'étude était la survie sans progression (SSP) évaluée selon les critères d'évaluation de la réponse dans les tumeurs solides (RECIST, Response Evaluation Criteria in Solid Tumors), sur la base de l'évaluation de l'investigateur (évaluation radiologique locale). Les analyses de confirmation de la SSP se sont basées sur une évaluation radiologique centralisée indépendante.
Les critères secondaires d'évaluation étaient la survie globale (SG), le taux de réponse objective, le taux de bénéfice clinique, la tolérance, la modification de la qualité de vie (QdV) et le délai de détérioration de l'indice de performance (PS, Performance Status) ECOG (Eastern Cooperative Oncology Group).
Au total, 724 patientes ont été randomisées selon un rapport de 2:1 pour recevoir l'association évérolimus (10 mg par jour) + exémestane (25 mg par jour) (n = 485) ou l'association placebo + exémestane (25 mg par jour) (n = 239). Au moment de l'analyse finale de la SG, la durée médiane du traitement par évérolimus était de 24,0 semaines (intervalle 1,0-199,1 semaines). La durée médiane du traitement par exémestane était plus longue dans le bras évérolimus + exémestane avec 29,5 semaines (1,0-199,1), contre 14,1 semaines (1,0-156,0) dans le bras placebo + exémestane.
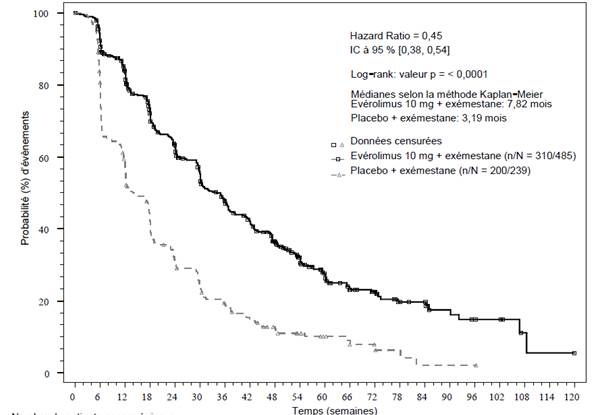
Les résultats d'efficacité pour le critère principal d'évaluation ont été obtenus à partir de l'analyse finale de la SSP (voir tableau 4 et figure 1). Il n'y avait pas de cross over vers le groupe évérolimus + exémestane pour les patientes du groupe placebo + exémestane au moment de la progression de la maladie.
Tableau 4 Résultats d'efficacité de BOLERO-2
|
Analyse |
Évérolimusa n = 485 |
Placeboa n = 239 |
HR (rapport de risque) |
Valeur de p |
|
|
Survie sans progression médiane (mois) (IC à 95 %) | |||||
|
Évaluation radiologique selon l'investigateur |
7,8 (6,9 à 8,5) |
3,2 (2,8 à 4,1) |
0,45 (0,38 à 0,54) |
< 0,0001 |
|
|
Évaluation radiologique indépendante |
11,0 (9,7 à 15,0) |
4,1 (2,9 à 5,6) |
0,38 (0,31 à 0,48) |
< 0,0001 |
|
|
Survie globale médiane (mois) (IC à 95 %) |
| ||||
|
Survie globale médiane |
31,0 (28,0 - 34,6) |
26,6 (22,6 - 33,1) |
0,89 (0,73 - 1,10) |
0,1426 |
|
|
Meilleure réponse globale (%) (IC à 95 %) |
| ||||
|
Taux de réponse objectiveb |
12,6 % (9,8 à 15,9) |
1,7 % (0,5 à 4,2) |
S/Od |
< 0,0001e |
|
|
Taux de bénéfice cliniquec |
51,3 % (46,8 à 55,9) |
26,4 % (20,9 à 32,4) |
S/Od |
< 0,0001e |
|
|
a Plus exémestane b Taux de réponse objective = proportion de patientes avec une réponse complète ou partielle c Taux de bénéfice clinique = proportion de patientes avec une réponse complète ou partielle ou une stabilisation de la maladie ≥ 24 semaines d Sans objet e La valeur de p est obtenue à partir du test exact de Cochran-Mantel-Haenszel en utilisant une version stratifiée du test de permutation de Cochran-Armitage. |
| ||||
Figure 1 BOLERO-2 - Courbes de Kaplan-Meier de la survie sans progression (évaluation radiologique de l'investigateur)
|
Nombre de patientes encore à risque | ||||||||||||||||||||||
|
Temps (semaines) |
0 |
6 |
12 |
18 |
24 |
30 |
36 |
42 |
48 |
54 |
60 |
66 |
72 |
78 |
84 |
90 |
96 |
102 |
108 |
114 |
120 |
|
|
Évérolimus |
485 |
436 |
366 |
304 |
257 |
221 |
185 |
158 |
124 |
91 |
66 |
50 |
35 |
24 |
22 |
13 |
10 |
8 |
2 |
1 |
0 |
|
|
Placebo |
239 |
190 |
132 |
96 |
67 |
50 |
39 |
30 |
21 |
15 |
10 |
8 |
5 |
3 |
1 |
1 |
1 |
0 |
0 |
0 |
0 |
|
L'effet estimé du traitement sur la SSP a été confirmé par une analyse en sous-groupes programmée de la SSP selon l'évaluation de l'investigateur. Pour tous les sous-groupes analysés (âge, sensibilité à l'hormonothérapie antérieure, nombre d'organes atteints, statut des lésions uniquement osseuses lors de l'inclusion et présence de métastases viscérales, et selon les sous-groupes pronostiques et démographiques majeurs), un effet positif du traitement a été observé sous évérolimus + exémestane avec un rapport de risque (HR) estimé compris entre 0,25 et 0,60 versus placebo + exémestane.
Aucune différence en termes de délai de détérioration ≥ 5 % des scores des domaines fonctionnels et du score global du QLQ-C30 n'a été observée entre les deux groupes de traitement.
Tumeurs neuroendocrines d'origine pancréatiques (pNET) avancées
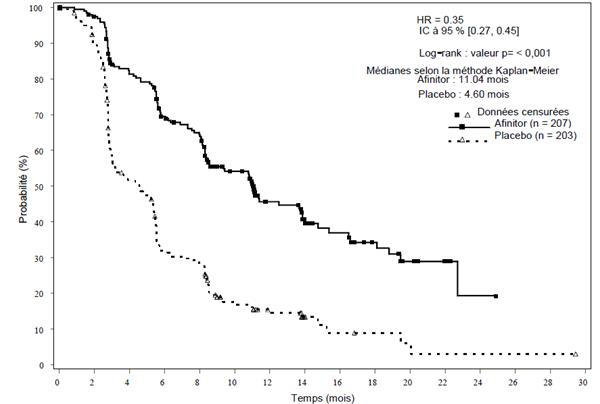
RADIANT-3 (étude CRAD001C2324), une étude de phase III, multicentrique, randomisée, en double aveugle de l'évérolimus + meilleur traitement de soutien (BSC, best supportive care) versus placebo + BSC chez des patients atteints de pNET avancées, a démontré un bénéfice clinique statistiquement significatif sous évérolimus versus placebo avec un allongement de 2,4 fois de la survie sans progression (SSP) médiane (11,04 mois versus 4,6 mois) (HR : 0,35 ; IC à 95 % : 0,27, 0,45 ; p < 0,0001) (voir tableau 5 et figure 2).
L'étude RADIANT-3 a été conduite chez des patients atteints de pNET avancées bien et moyennement différenciées dont la maladie avait progressé au cours des 12 mois précédents. Le traitement par analogues de la somatostatine était autorisé dans le cadre du meilleur traitement de soutien (BSC).
Le critère principal d'évaluation de l'étude était la SSP évaluée au moyen des critères d'évaluation de la réponse dans les tumeurs solides (RECIST, Response Evaluation Criteria in Solid Tumors). Après progression radiologique documentée, la levée de l'aveugle pour les patients concernés pouvait être faite par l'investigateur. Les patients randomisés dans le groupe placebo pouvaient alors recevoir de l'évérolimus en ouvert.
Les critères secondaires d'évaluation étaient la tolérance, le taux de réponse objective, la durée de la réponse et la survie globale (SG).
Au total, 410 patients ont été randomisés selon un rapport de 1:1 pour recevoir soit de l'évérolimus 10 mg/jour (n = 207) soit un placebo (n = 203). Les caractéristiques démographiques étaient bien équilibrées (âge médian : 58 ans, hommes : 55 %, Caucasiens : 78,5 %). Cinquante-huit pour cent des patients des deux groupes avaient reçu un traitement systémique antérieur. La durée médiane du traitement en aveugle était de 37,8 semaines (intervalle 1,1-129,9 semaines) pour les patients qui ont reçu l'évérolimus et 16,1 semaines (intervalle 0,4-147,0 semaines) pour ceux qui ont reçu un placebo.
Suite à une progression de la maladie ou après levée de l'aveugle, 172 des 203 patients (84,7 %) initialement randomisés dans le bras placebo ont effectué un cross over pour recevoir l'évérolimus en ouvert. La durée médiane de traitement en ouvert était de 47,7 semaines pour l'ensemble des patients : 67,1 semaines chez les 53 patients randomisés dans le bras évérolimus qui ont ensuite reçu de l'évérolimus en ouvert et 44,1 semaines chez les 172 patients randomisés dans le bras placebo qui ont ensuite reçu de l'évérolimus en ouvert.
Tableau 5 RADIANT-3 - Résultats en termes d'efficacité
|
Population |
Évérolimus n = 207 |
Placebo n = 203 |
HR (rapport de risque) (IC à 95 %) |
Valeur de p |
|
Survie sans progression médiane (mois) (IC à 95 %) | ||||
|
Évaluation radiologique de l'investigateur |
11,04 (8,41, 13,86) |
4,60 (3,06, 5,39) |
0,35 (0,27, 0,45) |
< 0,0001 |
|
Évaluation radiologique Indépendante |
13,67 (11,17, 18,79) |
5,68 (5,39, 8,31) |
0,38 (0,28, 0,51) |
< 0,0001 |
|
Survie globale médiane (mois) (IC à 95 %) | ||||
|
Survie globale médiane |
44,02 (35,61, 51,75) |
37,68 (29,14, 45,77) |
0,94 (0,73, 1,20) |
0,300 |
Figure 2 RADIANT-3 - Courbes de Kaplan-Meier de la survie sans progression (évaluation radiologique par l'investigateur)

|
Nombre de patients encore à risque | ||||||||||||||||
|
Évérolimus |
207 |
189 |
153 |
126 |
114 |
80 |
49 |
36 |
28 |
21 |
10 |
6 |
2 |
0 |
0 |
0 |
|
Placebo |
203 |
117 |
98 |
59 |
52 |
24 |
16 |
7 |
4 |
3 |
2 |
1 |
1 |
1 |
1 |
0 |
Autres études
La stomatite est l'effet indésirable le plus fréquemment rapporté chez les patients traités par évérolimus (voir rubriques Mises en garde et précautions d'emploi et Effets indésirables). Dans une étude post-autorisation en simple bras chez les femmes ménopausées atteintes d'un cancer du sein avancé (N = 92), un traitement local avec une solution orale de dexaméthasone 0,5 mg/5 ml sans alcool a été administré en bain de bouche (4 fois par jour pendant les 8 premières semaines de traitement) à partir de l'initiation du traitement par évérolimus (10 mg/jour) plus exémestane (25 mg/jour) pour réduire l'incidence et la gravité des stomatites. L'incidence des stomatites de Grade ≥ 2 après 8 semaines de traitement était de 2,4 % (n = 2/85 patients évaluables) ce qui était inférieur à l'incidence historiquement rapportée. L'incidence des stomatites de Grade 1 était de 18,8 % (n = 16/85) et aucun cas de stomatite de Grade 3 ou 4 n'a été rapporté. Le profil de sécurité global était cohérent avec celui qui avait été établi pour évérolimus en oncologie et dans la sclérose tubéreuse de Bourneville (STB), à l'exception d'une légère augmentation de la fréquence des candidoses buccales rapportées chez 2,2 % (n = 2/92) des patients.
Population pédiatrique
L'Agence européenne des médicaments a accordé une dérogation à l'obligation de soumettre les résultats d'études réalisées avec le médicament de référence dans tous les sous-groupes de la population pédiatrique atteints de tumeurs neuroendocrines d'origine pancréatique (voir rubrique Posologie et mode d'administration pour les informations concernant l'usage pédiatrique).
Chez les patients ayant des tumeurs solides avancées, les concentrations maximales (Cmax) d'évérolimus sont atteintes à une durée médiane d'une heure après l'administration quotidienne d'une dose orale de 5 à 10 mg à jeun ou avec un repas léger sans matières grasses. La Cmax est proportionnelle à la dose entre 5 mg et 10 mg. L'évérolimus est un substrat et un inhibiteur modéré de la PgP.
Effet des aliments
Chez des volontaires sains, l'exposition systémique à l'évérolimus 10 mg (mesurée par l'ASC) est diminuée de 22 % et le pic plasmatique de la Cmax est diminué de 54 % lorsque le médicament est pris avec un repas riche en graisses. Avec un repas léger, l'ASC est diminuée de 32 % et la Cmax est diminuée de 42 %. Les aliments n'ont toutefois pas eu d'effet apparent sur le profil de concentration en fonction du temps au cours de la phase post-absorption.
Distribution
Le rapport sang-plasma de l'évérolimus, qui est dépendant de la concentration sur l'intervalle de 5 à 5 000 ng/ml, est de 17 % à 73 %. Environ 20 % de la concentration de l'évérolimus dans le sang total est retrouvée dans le compartiment plasmatique chez les patients cancéreux recevant de l'évérolimus 10 mg par jour. La liaison aux protéines plasmatiques est d'environ 74 % chez les sujets sains et chez les patients présentant une insuffisance hépatique modérée. Chez les patients ayant des tumeurs solides à un stade avancé, le volume de distribution Vd était de 191 l dans le compartiment central apparent et de 517 l dans le compartiment périphérique apparent.
Biotransformation
L'évérolimus est un substrat du CYP3A4 et de la PgP. Après administration orale, l'évérolimus est le composé principal circulant dans le sang chez l'homme. Six métabolites principaux de l'évérolimus ont été identifiés dans le sang chez l'homme, incluant trois métabolites monohydroxylés, deux produits à cycle ouvert formés par hydrolyse et un conjugué phosphatidylcholine de l'évérolimus. Ces métabolites ont également été identifiés chez les espèces animales utilisées dans les études de toxicité et ils ont présenté une activité 100 fois plus faible environ que celle de l'évérolimus lui-même. Par conséquent, l'évérolimus est considéré comme responsable de la majorité de l'activité pharmacologique globale.
Elimination
La valeur moyenne de la clairance orale (CL/F) de l'évérolimus chez des patients ayant des tumeurs solides de stade avancé recevant 10 mg par jour était de 24,5 l/h. La valeur moyenne de la demi-vie d'élimination était approximativement de 30 heures.
Il n'a pas été mené d'études d'excrétion spécifiques chez les patients cancéreux, mais des données issues d'études menées chez des patients transplantés sont disponibles. Après administration d'une dose unique d'évérolimus radiomarqué en association avec la ciclosporine, 80 % de la radioactivité ont été retrouvés dans les fèces et 5 % ont été excrétés dans les urines. La molécule mère n'a pas été détectée dans les urines ou dans les fèces.
Pharmacocinétique à l'état d'équilibre
Après l'administration d'évérolimus chez des patients ayant des tumeurs solides de stade avancé, l'ASC0-τ a été dose-proportionnelle dans l'intervalle posologique de 5 mg à 10 mg par jour. L'état d'équilibre a été atteint en deux semaines. La Cmax est proportionnelle à la dose entre 5 mg et 10 mg. Le tmax est atteint 1 à 2 heures après l'administration. Il a été observé une corrélation significative entre l'ASC0-τ et la concentration résiduelle avant administration à l'état d'équilibre.
Populations particulières
Insuffisance hépatique
La sécurité d'emploi, la tolérance et la pharmacocinétique de l'évérolimus ont été évaluées dans deux études avec administration d'évérolimus en comprimé à dose unique par voie orale chez 8 et 34 sujets présentant une insuffisance hépatique comparés à des sujets ayant une fonction hépatique normale.
Dans la première étude, l'ASC moyenne de l'évérolimus chez 8 sujets présentant une insuffisance hépatique modérée (Child-Pugh B) était deux fois plus importante que celle retrouvée chez les 8 sujets présentant une fonction hépatique normale.
Dans la seconde étude réalisée chez 34 sujets présentant différents degrés d'insuffisance hépatique, une augmentation de l'exposition (c.-à-d., ASC0-inf) de 1,6 fois, 3,3 fois et 3,6 fois a été observée chez les sujets ayant une insuffisance hépatique respectivement légère (classe A de Child-Pugh), modérée (classe B de Child-Pugh) et sévère (classe C de Child-Pugh) par rapport aux sujets normaux.
Les simulations de pharmacocinétique en administration répétée viennent à l'appui des recommandations posologiques chez les sujets présentant une insuffisance hépatique déterminée selon leur statut Child-Pugh.
À partir des résultats de ces deux études, une adaptation de la posologie est recommandée chez les patients présentant une insuffisance hépatique (voir rubriques Posologie et mode d'administration et Mises en garde et précautions d'emploi).
Insuffisance rénale
Dans une analyse de pharmacocinétique de population chez 170 patients ayant des tumeurs solides de stade avancé, aucun effet significatif de la clairance de la créatinine (25-178 ml/min) n'a été observé sur la clairance orale (CL/F) de l'évérolimus. Une insuffisance rénale post-transplantation (clairance de la créatinine comprise entre 11 ml/min et 107 ml/min) n'a pas eu d'effet sur la pharmacocinétique de l'évérolimus chez des patients transplantés.
Patients âgés
Dans une analyse pharmacocinétique de population chez des patients cancéreux, aucun effet significatif de l'âge (27 à 85 ans) sur la clairance orale de l'évérolimus n'a été observé.
Groupe ethnique
La clairance orale (CL/F) est similaire chez les patients cancéreux japonais et caucasiens ayant une fonction hépatique comparable. Selon une analyse de pharmacocinétique de population, la CL/F est supérieure de 20 % en moyenne chez les patients transplantés de race noire.
L'évérolimus a semblé exacerber spontanément des pathologies préexistantes (myocardite chronique chez le rat, infection du plasma et du coeur par le virus Coxsackie chez le singe, infestation coccidienne du tractus gastro-intestinal chez le cochon nain, lésions cutanées chez la souris et le singe). Ces effets ont été généralement observés à des niveaux d'exposition systémique équivalents ou supérieurs aux niveaux d'exposition thérapeutique, à l'exception des effets observés chez le rat, qui se sont produits à des niveaux inférieurs à l'exposition thérapeutique en raison d'une distribution tissulaire élevée.
Au cours d'une étude de fertilité chez le rat mâle, la morphologie testiculaire a été affectée à des doses de 0,5 mg/kg et plus et la motilité et le nombre de spermatozoïdes et le taux plasmatique de testostérone ont été diminués à la dose de 5 mg/kg, ce qui a entraîné une diminution de la fertilité des mâles. Ces altérations ont été réversibles.
Au cours des études portant sur la fonction de reproduction réalisées chez l'animal, la fertilité des femelles n'a pas été affectée. Cependant, chez le rat femelle, les doses orales d'évérolimus ≥ 0,1 mg/kg (environ 4 % de l'ASC0-24h des patients recevant 10 mg par jour) ont entrainé une augmentation des pertes préimplantatoires.
L'évérolimus a traversé la barrière placentaire et s'est avéré toxique pour le foetus. Chez le rat, l'évérolimus a provoqué une embryo/foetotoxicité se manifestant par une mortalité et une réduction du poids foetal à un niveau d'exposition systémique inférieur au niveau thérapeutique. L'incidence de modifications et de malformations du squelette (fente sternale par exemple) a été augmentée aux doses de 0,3 mg/kg et 0,9 mg/kg. Chez le lapin, l'embryotoxicité s'est manifestée par une augmentation des résorptions tardives.
Les études de génotoxicité évaluant les critères pertinents n'ont pas mis en évidence d'activité clastogène ou mutagène. L'administration d'évérolimus pendant des durées allant jusqu'à 2 ans n'a pas indiqué de potentiel oncogène chez la souris et le rat jusqu'aux doses les plus élevées, correspondant respectivement à 3,9 et 0,2 fois l'exposition clinique estimée.
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
Liste I.
Médicament nécessitant une surveillance particulière pendant le traitement.
Prescription hospitalière.
Prescription réservée aux spécialistes et services de cancérologie, d'hématologie, et d'oncologie médicale.
Comprimé ovale, plat, blanc à blanc cassé, d'environ 10 mm de long et 4 mm de large, portant la mention « EVR » sur une face et « 2,5 » sur l'autre face.
Plaquettes en OPA/Aluminium/PVC//Aluminium.
Boîte 30 comprimés.
